
2025-04-22 09:23:57
eCTD在歐盟藥品監管中的歷史背景:歐盟eCTD(電子通用技術文檔)的發展始于對臨床試驗和藥品審評流程標準化的需求。2001年,歐盟引入《臨床試驗指令》(CTD)作為統一的法律框架,但其分散的成員國申報機制導致效率低下。2014年,歐盟通過《臨床試驗法規》(CTR, Regulation EU No. 536/2014),要求通過CTIS平臺(臨床試驗信息系統)集中提交臨床試驗申請(CTA),并逐步推動eCTD作為電子化申報的工具。這一旨在解決傳統CTD模式下審評周期長、多國協調成本高的問題,為eCTD的實施奠定了基礎。eCTD驗證標準相關技術支持。浙江國內注冊eCTD格式
多國審評程序與eCTD遞交途徑的適配:歐盟藥品審評程序包括集中(CP)、分散(DCP)、互認(MRP)和**程序(NP),eCTD需適配不同程序的遞交要求。例如: ?集中審評程序(CP)?:通過EMA的eSubmission Gateway提交,審評時限約240個工作日,eCTD需包含完整的模塊1-5及多語言標簽文件。 ?分散審評程序(DCP)?:需通過CESP(歐盟共同提交門戶)遞交,參考成員國(RMS)主導審評,eCTD需支持多國同步評估的模塊化拆分。 ?互認程序(MRP)?:已授權成員國作為RMS,eCTD需包含基線序列(Baseline Sequence 0000)以整合歷史審評數據,并通過CMDh協調分歧。青海eCTD系統瑞士eCTD注冊申報相關技術支持。

eCTD生命周期管理與變更提交:歐盟要求eCTD申報資料覆蓋藥品全生命周期,包括提交、補充申請及實質性變更。例如,增成員國需提交“附加成員國序列”,審評時間約52-83天;重大變更(如生產工藝調整)需創建序列并通過CTIS平臺更模塊3和模塊1的GMP證明。技術驗證工具(如EDQM推薦的檢查軟件)需在每次提交前運行,確保XML骨架文件與PDF書簽層級符合規范。此外,電子簽章需符合《歐盟電子簽名法》,并在模塊1中明確標注法律效力。歐洲通用提交門戶(Common European Submission Portal,CESP)是歐盟及成員國藥品監管機構間用于電子化提交申報資料的重要平臺。以下是關于CESP的詳細介紹: CESP是由歐盟藥品監管部門負責人網絡(HMA)合作開發的在線交付系統,旨在為藥品注冊申請者、利益相關方和監管機構之間提供統一、**的電子提交通道。其設計初衷是簡化跨國申報流程,允許通過單一門戶向多個歐洲**的藥監部門同時提交申請,避免了重復操作。
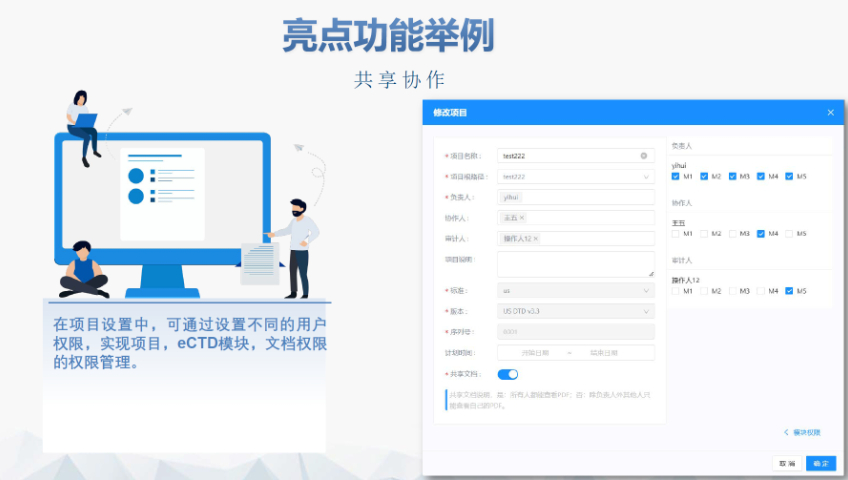
法規文檔管理系統 協同共享 RDMS可以讓跨區域、跨部門協同真正成為1+1>2的 工作。讓頻繁的文檔共享傳輸,版本管理,生命周 期審批都變得輕松簡單 **合規 通過詳細的審計追蹤、電子簽名、權限管理、網 關控制、頁面控制等技術手段,構建**合規的 文檔管理系統,通過**驗證與合規驗證 統一文檔來源 藥品注冊是企業經營成果的技術資料,由多個部門 長時間匯集到法規部門。RDMS確保多部門文檔來 源統一,即使人員流動也可以快速接續工作 統一文檔結構 根據不同申報類型,自動生成文檔結構,讓法規 人員與跨部門同事掌握申報需要的資料需求,降 低溝通成本,降低經驗需求,避免疏忽遺漏eCTD驗證實踐手冊相關技術支持。
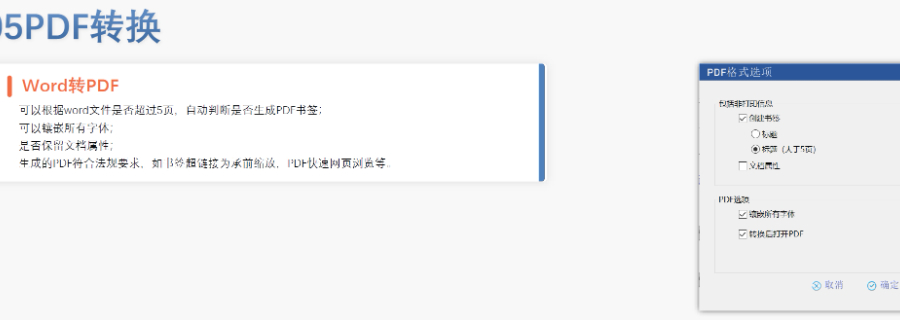
eCTD提交流程與ESG系統:FDA要求通過電子提交網關(ESG)傳輸eCTD文件,單個文件大小限制為10GB,超限需拆分或通過物理介質(如光盤)遞交。提交前需預分配申請號(如NDA編號),并通過ESG測試賬戶驗證技術合規性。序列號命名規則為4位數字(如0001),申請需從“原申請”序列開始,補充資料按遞增順序編號。企業可自愿提交預審樣本(Pre-Submission),FDA將反饋文檔結構、元數據等合規性問題。驗證標準與常見錯誤類型:FDA驗證標準分為高(High)、中(Medium)、低(Low)三級,高風險錯誤(如無效XML或缺失關鍵表格)必須修復,否則直接拒收。常見問題包括:重復序列號(錯誤1034)、文件路徑超長(警告2015)、PDF加密或非標字體(錯誤4001)。2023年統計顯示,30%的提交因模塊1格式錯誤被退回,凸顯**信息合規的重要性。驗證工具如LORENZ eValidator被FDA官方采用,可自動檢測200+項技術指標。瑞士IND注冊申報相關技術支持。青海eCTD系統
美國eCTD注冊外包相關技術支持。浙江國內注冊eCTD格式
eCTD驗證標準的嚴格性與分類:歐盟對eCTD的驗證要求分為“錯誤”“警告”和“提示信息”三級,其中“錯誤”項直接導致申報被拒。驗證項目涵蓋六大類共149條,包括文件命名規范(如路徑長度限制)、PDF可讀性(禁止密碼保護)、XML骨架文件完整性等。例如,文件擴展名必須符合規范(如.xpt用于臨床數據集),而文件夾層級需避免空目錄或混合存放文件。相較于中國《電子申報驗證標準》的簡化版(54條),歐盟的驗證體系更為復雜,體現了其高標準的技術監管。浙江國內注冊eCTD格式